二月医药政策合集
对于医药企业而言,医药行业发布的新政策、新法规往往会影响企业今后的发展和走向,近期医药行业风云变幻,重磅政策频发,二月份主要政策如下:
PART-01国家药品监督管理局
PART-02药审中心
PART-01国家药品监督管理局
1.已上市化学药品变更事项及申报资料要求
为配合药品注册管理办法实施,国家药品监督管理局于2月10日发布了《已上市化学药品变更事项及申报资料要求》,自发布之日起实施。文件内容涉及国家药品监管部门审批的补充申请事项、国家或省级药品监管部门备案事项以及年报事项,药品上市许可持有人应根据所申请事项,按文件要求提交申报资料,不适用的项目应注明不适用并说明理由,年报事项按照国家药品监管部门公布的有关年报的相关规定执行。
2.第三十七和第三十八批仿制药参比制剂目录
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,国家药监局先后于2月7日和23日正式发布了《仿制药参比制剂目录(第三十七批)》《仿制药参比制剂目录(第三十八批)》。
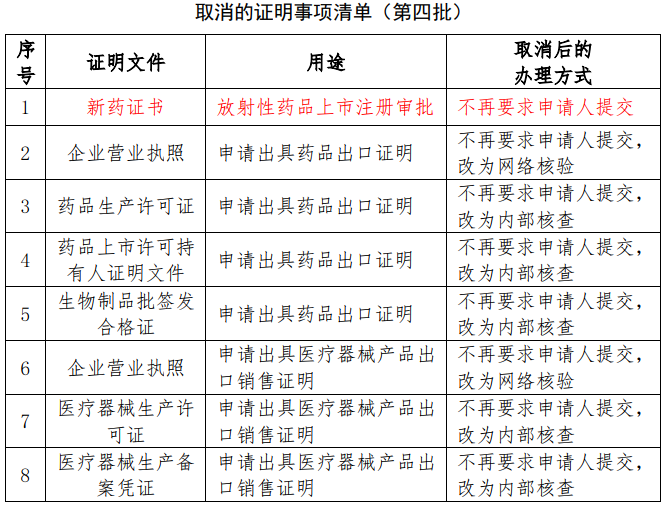
3.取消8项证明事项的公告
为进一步减证便民、优化服务,国家药品监督管理局于2月9日发布了《关于取消8项证明事项的公告(第四批)》(详见下表),所列证明事项自公告发布之日起停止执行。

PART-02药审中心
4.多项技术指导原则/指南/规范
近日,药审中心发布了多项技术指导原则/指南/规范,包括:
(1)《放射性体内诊断药物非临床研究技术指导原则》
(2)《药审中心技术审评报告公开工作规范(试行)》
(3)《生物类似药相似性评价和适应症外推技术指导原则》
(4)《化学药品变更受理审查指南(试行)》
(5)《已上市化学药品药学变更研究技术指导原则(试行)》
(6)《已上市化学药品和生物制品临床变更技术指导原则》
(7)《氟维司群注射液仿制药研究技术指导原则(试行)》
(8)《静注人免疫球蛋白治疗原发免疫性血小板减少症临床试验技术指导原则(试行)》
(9)《免疫细胞治疗产品临床试验技术指导原则(试行)》
(10)《溶瘤病毒类药物临床试验设计指导原则(试行)》
(11)《复杂性腹腔感染抗菌药物临床试验技术指导原则》
(12)《治疗性蛋白药物临床药代动力学研究技术指导原则》
(13)《注射用奥马珠单抗生物类似药临床试验指导原则》
(14)《流行性感冒治疗和预防药物临床试验技术指导原则》
(15)《药物临床试验适应性设计指导原则(试行)》
5.多项征求意见稿
(1)《基因修饰细胞治疗产品非临床研究与评价技术指导原则(试行)(征求意见稿)》
(2)《基因治疗产品非临床研究与评价技术指导原则(征求意见稿)》
(3)《第一批拟不推荐参比制剂化药品种药学研究技术要求(征求意见稿)》
(4)关于ICH Q5D、M9及M9问答实施建议公开征求意见:申请人需在现行技术要求基础上,尽早按照ICH指导原则的要求开展研究;本公告发布之日起6个月后开始的相关研究(以试验记录时间点为准),适用上述ICH指导原则。


