Release of “Document of Drug Centralized Procurement in Alliance Region”: the “4+7” policy has expanded to the whole nation
《联盟地区药品集中采购文件》发布,4+7拓展到全国


9月1日,上海阳光医药采购网发布《联盟地区药品集中采购文件》,在国家组织药品集中采购和使用试点城市(以下简称4+7城市)及已跟进落实省份执行集中采购结果的基础上,国家组织相关地区形成联盟,依法合规开展跨区域联盟药品集中带量采购。联盟地区包括山西、内蒙古、辽宁、吉林、黑龙江、江苏、浙江、安徽、江西、山东、河南、湖北、湖南、广东、广西、海南、四川、贵州、云南、西藏、陕西、甘肃、青海、宁夏、新疆(含新疆生产建设兵团),联盟地区4+7城市除外。
采购品种及约定采购量
(一)采购品种为阿托伐他汀口服常释剂型等25个品种,具体采购品种(指定规格)目录、首年约定采购量计算基数及相应比例采购量(单位:万片/万袋/万支)详见附表。
(二)约定采购量
1. 本次集中采购药品首年约定采购量计算基数由各联盟地区确定。
2. 首年约定采购量按以下规则确定:实际中选企业为1家的,约定采购量为首年约定采购量计算基数的50%;实际中选企业为2家的,约定采购量为首年约定采购量计算基数的60%;实际中选企业为3家的,约定采购量为首年约定采购量计算基数的70%。
3. 次年约定采购量按该采购品种(指定规格)首年实际采购量一定比例确定:实际中选企业为1家的,约定采购量为首年实际采购量的50%;实际中选企业为2家的,约定采购量为首年实际采购量的60%;实际中选企业为3家的,约定采购量为首年实际采购量的70%。次年约定采购量原则上不少于该中选品种首年约定采购量。


申报资格
(一)申报企业:是指提供药品及伴随服务的国内药品生产企业,药品上市许可持有人,进口药品国内总代理视同生产企业。
(二)申报品种:是指采购品种目录范围内获得国内有效注册批件的上市药品。
(三)申报要求:
1. 中选企业须确保在采购周期内满足供应地区中选药品约定采购量需求。
2. 申报品种属于采购品种目录范围,且满足以下要求之一:
2.1 原研药及国家药品监督管理局发布的仿制药质量和疗效一致性评价参比制剂。
2.2 通过国家药品监督管理局仿制药质量和疗效一致性评价的仿制药品。
2.3 根据《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》〔2016年第51号〕,按化学药品新注册分类批准的仿制药品。
2.4 纳入《中国上市药品目录集》的药品。
3. 企业在申报品种时必须包含采购品种目录指定的主品规。
采购执行说明
(一)集中采购结果执行周期中,医疗机构将优先使用本省(区)集中采购中选品种,并确保完成约定采购量。
(二)联盟地区医疗机构在优先使用本省(区)集中采购中选品种的基础上,剩余用量可按所在地区药品集中采购管理有关规定,适量采购同品种价格适宜的其他药品。
采购周期与采购协议
(一)采购周期按以下规则确定:中选企业不超过2家(含)的品种,本轮采购周期原则上为1年;中选企业为3家的品种,本轮采购周期原则上为2年。采购周期视实际情况可延长一年。
(二)采购周期内采购协议每年一签。
(三)采购周期内若提前完成当年约定采购量,超过部分中选企业仍按中选价进行供应,直至采购周期届满。

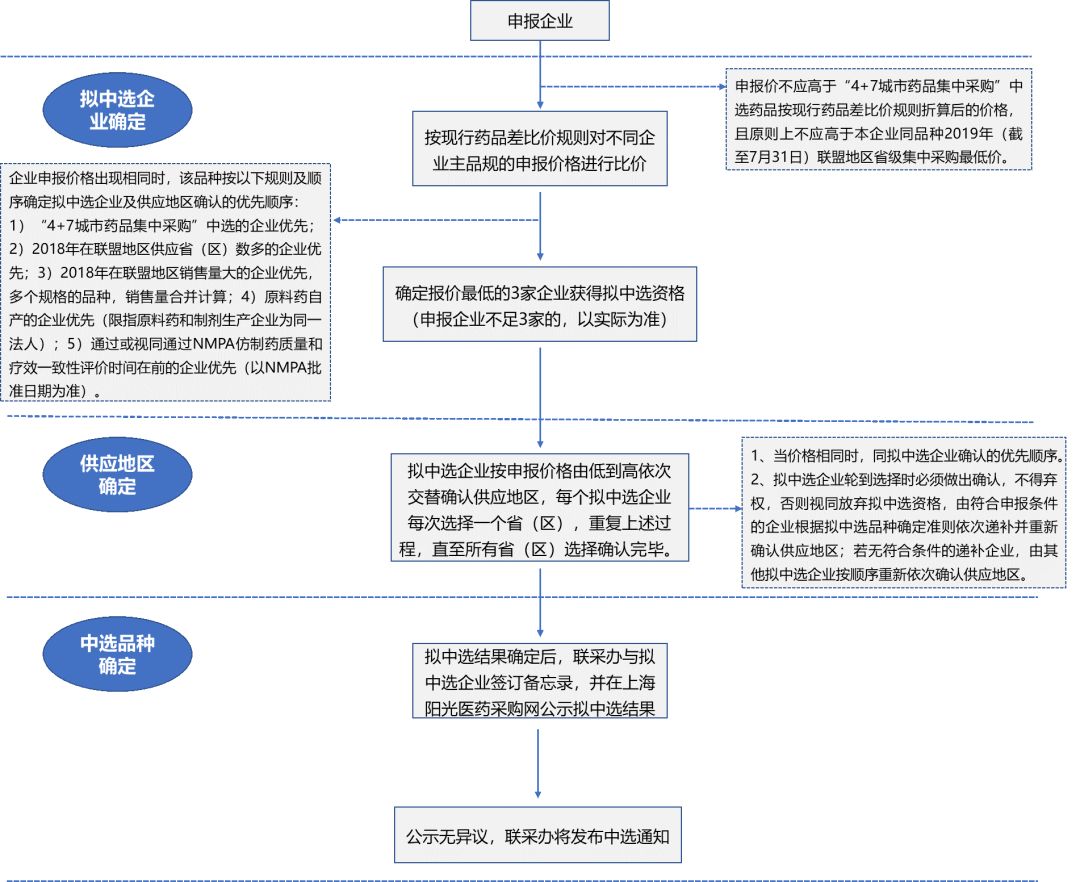
申报流程
附表1 采购品种及约定采购量