法规动态
-

医药政策周报(2021.04.05)
3月29日,国家药监局药审中心发布《药物免疫原性研究技术指导原则》(以下简称《指导原则》),以进一步规范和指导药物免疫原性研究,为工业界、研究者及监管机构提供技术参考。《指导原则》内容包括概述、免疫原性研究内容、抗药抗体检测以及附录四部分内容,适用于治疗性蛋白质、多肽及其衍生物,以及含有此类组分的药物,例如抗体偶联药物。其他具有潜在免疫原性风险的药物也可参考该指导原则。《指导原则》自发布之日起施行。2021-04-05 -

医药政策周报(2021.03.22)
1.国家药监局药审中心关于发布《创新药(化学药)临床试验期间药学变更技术指导原则(试行)》的通告(2021年第22号)2021-03-22
3月12日,药审中心发布了《创新药(化学药)临床试验期间药学变更技术指导原则(试行)》(以下简称《指导原则》),自发布之日起施行。《指导原则》所述药学变更系指发生(或拟发生)在临床样品生产、质量控制、包装和贮藏条件等方面的变更,适用于化学创新药和改良型新药(放射药除外)临床试验期间的药学变更。考虑到创新药药学研究的阶段性、药学变更的多样性和复杂性,《指导原则》主要阐述了创新药药学变更评估和研究的一般原则,仅对部分常见的重大变更和一般变更进行了举例,并简述了该类变更下的研究思路和研究内容。对于未明确列出的其他变更形式,申请人可参考本《指导原则》或其他相关指导原则,根据变更具体情形开展评估和研究。对于多个变更同时发生并存在关联的情况,可参考《指导原则》基本思路分别开展研究,总体上可按照技术要求较高的变更类别开展相关变更支持性研究工作,并关注多项变更可能的叠加影响。 -

医药政策周报(2021.03.15)
1.药审中心发布《境外已上市境内未上市化学药品药学研究与评价技术要求(试行)》2021-03-15
3月8日,药审中心发布了《境外已上市境内未上市化学药品药学研究与评价技术要求(试行)》(以下简称《技术要求》),以进一步指导企业开展药品研发,加快境外已上市境内未上市化学药品研发上市进程。文件自发布之日起施行。《技术要求》适用于境外已上市境内未上市的化学药品,主要包括境内申请人仿制境外上市但境内未上市原研药品的药品,即化学药品 3 类;境外上市的药品申请在境内上市,即化学药品 5 类(不适用于原研药品已在境内上市的化学药品 5.2 类)两类情形。同时,与境外已上市境内未上市制剂关联申报的原料药也适用于该《技术要求》。 -

行业政策:GLP认证公告 & 第三十九批仿制药参比制剂目录
近日,国家药品监督管理局组织有关专家对北京市药品检验所(药物安全评价中心)等7家机构进行了检查。经审核,该7家机构的单次和多次给药毒性试验(啮齿类)等试验项目符合药物GLP要求。2021-03-08 -
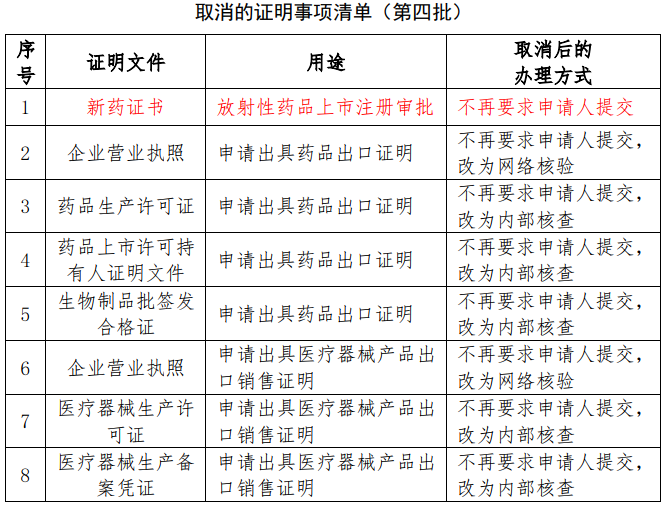
二月医药政策合集
对于医药企业而言,医药行业发布的新政策、新法规往往会影响企业今后的发展和走向,近期医药行业风云变幻,重磅政策频发,二月份主要政策如下:2021-03-01 -

一月医药政策合集
为规范和指导当前抗肿瘤新药临床试验过程中影像学相关的设计和实施,提高影像学相关终点的评价质量,为行业提供技术参考,经前期公开征求意见,药审中心于1月15日发布了《抗肿瘤药临床试验影像评估程序标准技术指导原则》,自发布之日起施行。指导原则以临床试验影像的设计、实施和数据管理方面的考虑为逻辑,阐述了临床试验影像评估程序标准化的研发和审评考虑,并附影像章程的规范化和科学性考虑,以及上市申请时影像相关资料建议清单,为医药研发企业、影像合同研究机构、研究者及各临床试验参与者提供临床试验影像评估程序标准化和资料准备建议。2021-02-01


